
Da Pfizer a Moderna: somiglianze e differenze tra i primi due vaccini anti-Covid approvati dall’EMA
di Ylenia Nicolini
Lo scorso 6 gennaio 2021 il vaccino anti-Covid Moderna ha ricevuto l’approvazione dell’EMA, l’Agenzia europea per i medicinali, il cui ruolo è quello di valutare, monitorare e controllare la sicurezza dei farmaci per uso umano e veterinario nell’Unione europea (UE). L’efficacia di questo vaccino, del 94,1%, è stata calcolata su un totale di circa 28 000 persone di età compresa tra i 18 e i 94 anni, e si è rivelata del 90,9% nei partecipanti a rischio di Covid-19 severa, inclusi i soggetti affetti da malattie polmonari croniche, patologie cardiache, obesità, diabete, infezione da HIV. Come precedentemente menzionato https://www.mondadorieducation.it/covid-19-vaccini-contro-il-nuovo-coronavirus-a-confronto/, si tratta di un vaccino a mRNA. Una dose di vaccino, quindi, contiene una molecola di RNA messaggero dotata di tutte le informazioni necessarie affinché le cellule del nostro corpo possano sintetizzare la proteina Spike del coronavirus SARS-CoV-2. Dopo aver ricevuto il vaccino, l’organismo inizia a produrre tale proteina, che sarà riconosciuta come “estranea” dal sistema immunitario, che a sua volta si attiverà per produrre gli anticorpi e reclutare linfociti killer con lo scopo di neutralizzare gli “invasori”. Solo in seguito a questo primo contatto con l’antigene (la proteina Spike) il sistema immunitario sarà in grado di riconoscere e difendere l’organismo, nel caso in cui quest’ultimo venga infettato dal virus “vero” (Figura 1). L’mRNA iniettato, invece, essendo una molecola altamente instabile, verrà degradato nell’arco di qualche ora o entro pochi giorni dalla vaccinazione. Infatti, a differenza della doppia elica di DNA, resa particolarmente stabile dalla capacità delle basi azotate di formare legami a idrogeno, ciascun filamento singolo di mRNA, molto meno stabile, è sottoposto di continuo alla funzione degradante delle RNAsi, le ribonucleasi capaci di idrolizzare l’RNA a singolo filamento.
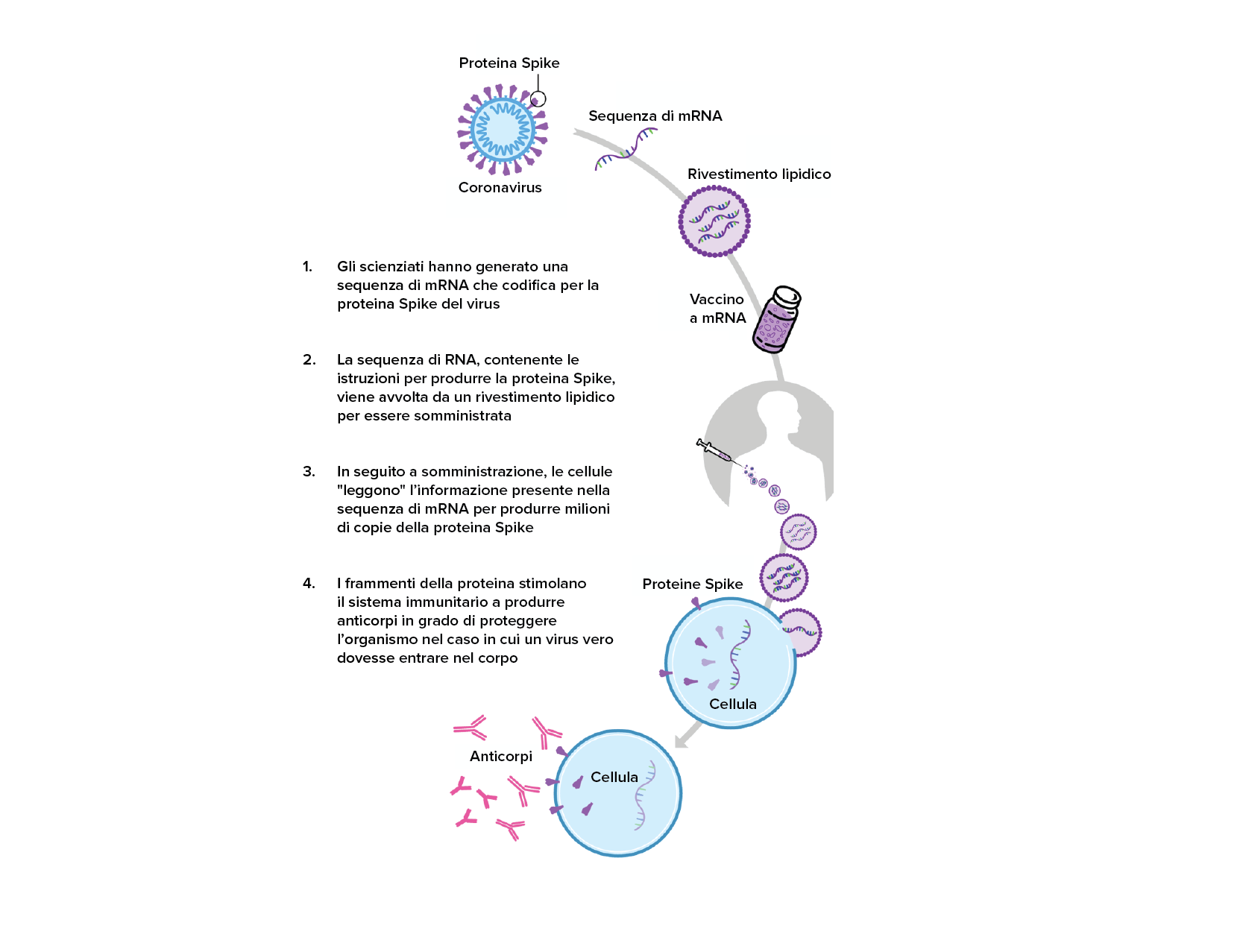
Come Moderna, anche il vaccino Pfizer-BioNTech, approvato dall’EMA lo scorso 21 dicembre ed efficace nel 95% dei casi, rientra nella categoria dei “farmaci a mRNA”. Tuttavia, le due preparazioni vaccinali presentano alcune differenze importanti, in particolare relative alla temperatura di conservazione. Perché il vaccino Moderna può essere conservato a temperature di +2/+8 °C per 30 giorni, mentre quello di Pfizer richiede una temperatura di conservazione di -70 ± 10 °C?
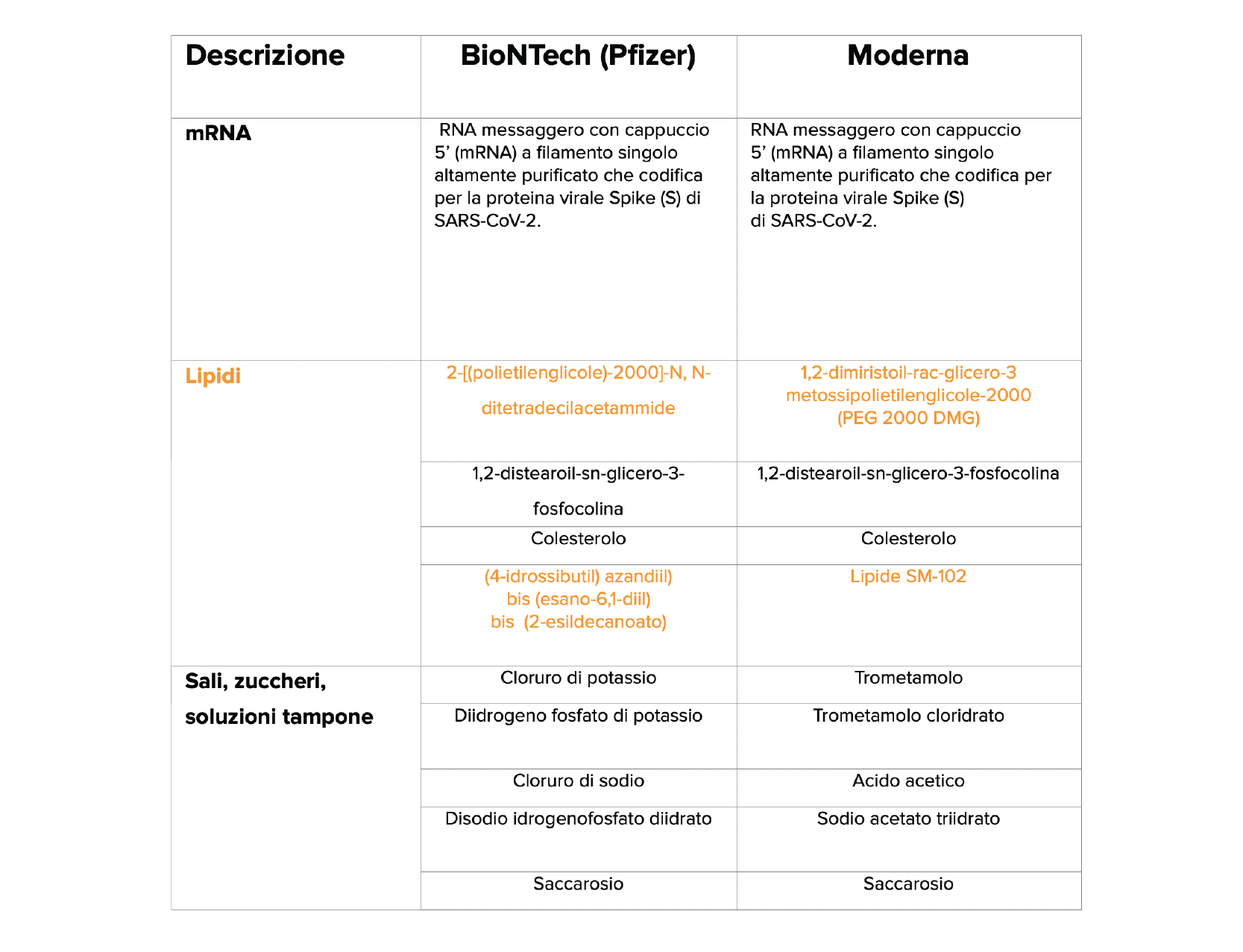
In entrambi i vaccini, affinché l’mRNA a singola elica sia trasportato “in vivo” e riesca a raggiungere il citoplasma delle cellule senza essere degradato nella circolazione sanguigna, viene incapsulato all’interno di nanoparticelle lipidiche (LNPs), lipidi della dimensione di pochi nanometri sempre più utilizzati nel drug delivery (somministrazione di farmaci), in particolare per la somministrazione di acidi nucleici con scopi terapeutici. Una tipica nanoparticella è composta da 4 parti: il lipide ionizzabile, che consente alla nanoparticella di auto-assemblarsi; gli agenti stabilizzanti che conferiscono stabilità alla struttura a doppio strato quali il colesterolo, un fosfolipide e il polietilenglicole (PEG).
Poiché l’mRNA si degrada con grandissima facilità, la conservazione dei vaccini a temperature molto basse consente di rallentare le reazioni chimiche interne e di mantenere integra la sua struttura. Anche le nanoparticelle sono particolarmente sensibili al calore; tuttavia, la differenza in termini di temperatura di conservazione tra i vaccini Pfizer e Moderna è proprio da ricondurre alle differenze tra questi nano-trasportatori lipidici (Tabella 1). Nel caso di Moderna, infatti, alcuni dei lipidi che costituiscono le nanoparticelle lipidiche rendono il vaccino più “stabile” e quindi conservabile in frigorifero per 30 giorni perché meno sensibile alle temperature.
In entrambi i vaccini, affinché l’mRNA a singola elica sia trasportato “in vivo” e riesca a raggiungere il citoplasma delle cellule senza essere degradato nella circolazione sanguigna, viene incapsulato all’interno di nanoparticelle lipidiche (LNPs), lipidi della dimensione di pochi nanometri sempre più utilizzati nel drug delivery (somministrazione di farmaci), in particolare per la somministrazione di acidi nucleici con scopi terapeutici. Una tipica nanoparticella è composta da 4 parti: il lipide ionizzabile, che consente alla nanoparticella di auto-assemblarsi; gli agenti stabilizzanti che conferiscono stabilità alla struttura a doppio strato quali il colesterolo, un fosfolipide e il polietilenglicole (PEG).
Poiché l’mRNA si degrada con grandissima facilità, la conservazione dei vaccini a temperature molto basse consente di rallentare le reazioni chimiche interne e di mantenere integra la sua struttura. Anche le nanoparticelle sono particolarmente sensibili al calore; tuttavia, la differenza in termini di temperatura di conservazione tra i vaccini Pfizer e Moderna è proprio da ricondurre alle differenze tra questi nano-trasportatori lipidici (Tabella 1). Nel caso di Moderna, infatti, alcuni dei lipidi che costituiscono le nanoparticelle lipidiche rendono il vaccino più “stabile” e quindi conservabile in frigorifero per 30 giorni perché meno sensibile alle temperature.
Sitografia:
https://www.ema.europa.eu/en/news/ema-recommends-covid-19-vaccine-moderna-authorisation-eu
https://www.ema.europa.eu/en/news/ema-recommends-first-covid-19-vaccine-authorisation-eu
https://www.ema.europa.eu/en/documents/product-information/covid-19-vaccine-moderna-product-information_en.pdf
https://www.modernatx.com
https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/948517/Information_for_Healthcare_Professionals_on_Pfizer_BioNTech.pdf
https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/pfizer-biontech-covid-19-vaccine
https://www.nature.com/articles/s41565-020-00820-0#citeas
https://www.nature.com/articles/s41565-020-00820-0#citeas
https://www.health.com/condition/infectious-diseases/coronavirus/why-does-the-covid-19-vaccine-have-to-be-kept-so-cold
Bibliografia:
de Oliveira Cardoso, V. M., Moreira, B. J., Comparetti, E. J., Sampaio, I., Ferreira, L. M. B., Lins, P. M. P., & Zucolotto, V. Is Nanotechnology Helping in the Fight Against COVID-19?.
Polack, F. P., Thomas, S. J., Kitchin, N., Absalon, J., Gurtman, A., Lockhart, S., ... & Gruber, W. C. (2020). Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. New England Journal of Medicine.Sahin, U., Muik, A., Derhovanessian, E., Vogler, I., Kranz, L. M., Vormehr, M., ... & Türeci, Ö. (2020). COVID-19 vaccine BNT162b1 elicits human antibody and TH 1 T cell responses. Nature, 586(7830), 594-599.















