
Acidità di mare
di Edwige Pezzulli
- Obiettivo primario: 13 - Lotta al cambiamento climatico
- Obiettivo secondario: 14 - Vita sott'acqua
- Materie: Fisica, chimica, biologia
Dall'aria all'acqua
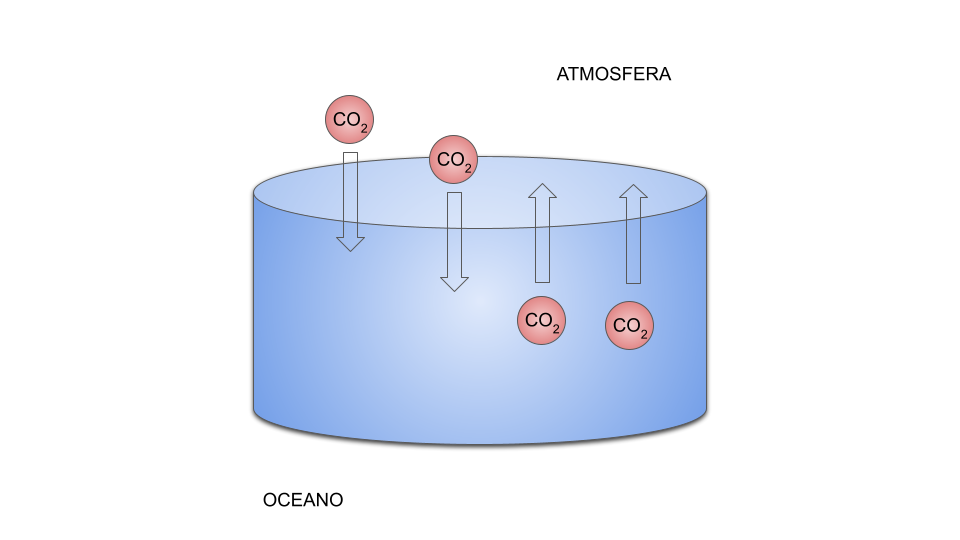
È proprio questo il meccanismo grazie al quale le acque del nostro Pianeta assorbono gran parte dei gas nell’atmosfera, primo tra tutti il diossido di carbonio (CO2).
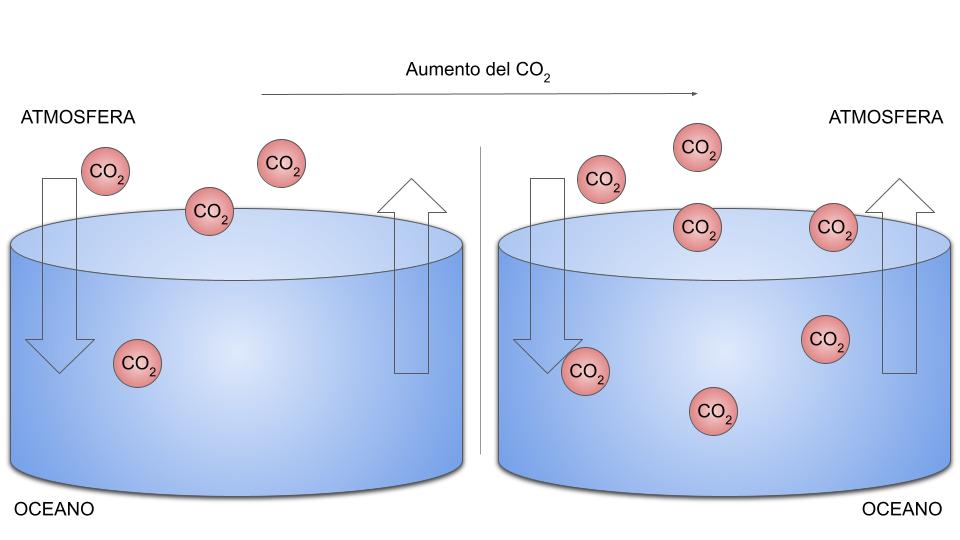
Grazie a una relazione matematica chiamata legge di Henry, sappiamo che maggiore è la quantità di gas nell’atmosfera, maggiore sarà anche la sua concentrazione nei mari. Non c’è da stupirsi, allora, se le continue emissioni di diossido di carbonio provochino una crescita vertiginosa della quantità di CO2 all’interno delle acque. In un recente studio pubblicato su Nature Comunications, è stato stimato che circa il 25% di CO2 immesso nell’atmosfera ogni anno, è assorbito dagli oceani.
Se da una parte, quindi, i mari rappresentano dei potenti alleati nella riduzione della quantità di CO2, dall’altro, questo processo mette purtroppo a dura prova l’equilibrio dell’ecosistema marino.
Il processo di acidificazione
CO2 + H2O ⇄ H2CO3
il quale, a sua volta, rilascia nell’acqua degli ioni idrogeno H+.
Il numero di ioni H+ in una soluzione è espresso tramite un parametro, il pH, che quantifica l’acidità della soluzione: maggiore è il numero di ioni H+, minore è il valore del pH.
La scala di valori del pH va da 0 a 14: una soluzione neutra ha un pH uguale a 7, come per l’acqua pura. Sostanze con un pH maggiore di 7 sono definite basiche, come l’ammoniaca o i saponi comuni. Al contrario, un pH minore di 7 caratterizza le sostanze acide: l’aceto che usiamo in cucina, per esempio, ha un pH di circa 2,3.
Quando il CO2 che immettiamo nell’atmosfera è assorbito dagli oceani, il loro pH diminuisce e l’ambiente marino diventa via via più acido. Negli ultimi anni, il pH dei mari è diminuito di 0,1, una variazione che può sembrare piccola ma che rappresenta una modifica pericolosa per gli ecosistemi marini.
Le conseguenze
Abbiamo visto che quando il diossido di carbonio e l’acqua entrano in contatto, reagiscono formando l’acido carbonico (H2CO3), che a sua volta libera ioni H+, dando così vita a quel fenomeno chiamato acidificazione degli oceani. Per ovviare a questo cambiamento nel pH, si attiva però un meccanismo, detto “sistema tampone”: il carbonato (CO32-) naturalmente presente nelle acque dei mari, inizia a catturare gli ioni H+, formando bicarbonato (HCO3-):
CO32- + H+ ⇄ HCO3-
Il carbonato, infatti, si combina con il calcio per formare il carbonato di calcio (CaCO3), il calcare che noi rimuoviamo dal fondo dei bollitori ma che è invece indispensabile per costruire i gusci e gli esoscheletri di questi animali. Più aumenta l’acidità delle acque, quindi, più la sopravvivenza di certi organismi è minacciata e, con essa, quella di molte altre forme di vita. La barriera corallina, per esempio, è uno straordinario ecosistema ricco di biodiversità, la cui esistenza è già messa a dura prova dall’innalzamento delle temperature. La sua morte, favorita dal processo di acidificazione, rappresenterebbe una vera e propria catastrofe ambientale.
Al contrario, alcuni esseri viventi potrebbero trarre beneficio da una maggior presenza di CO2 negli oceani poiché questa molecola favorisce la loro crescita. Anche in questo caso, però, le conseguenze per l’ecosistema marino nel suo insieme sarebbero disastrose: il processo di acidificazione, per esempio, favorisce la riproduzione della Vicicitus globosus, un’alga tossica per alcuni organismi come il plancton, base della catena alimentare marina. Se l’alga prolifera, quindi, si genera un effetto negativo a cascata sul nutrimento di gran parte della fauna acquatica.
A prescindere dalle singole specie, quindi, l’acidificazione degli oceani è responsabile di una profonda alterazione degli ecosistemi marini, con conseguenze a lungo termine potenzialmente fatali per la sopravvivenza della vita marina cosi come la conosciamo oggi.
Anche in questo caso, la soluzione è ridurre drasticamente le emissioni nel minor tempo possibile: l’acidità degli oceani, stabile fino a 150 anni fa, è iniziata a crescere, con una brusca accelerazione negli anni ‘50 e ora rischia di aumentare del 150% entro il 2100.
Si tratta di ambienti essenziali per la vita, sia per la sua origine sia per la sua sopravvivenza. In fin dei conti, sono proprio i mari a caratterizzare la Terra, un pianeta la cui superficie è coperta al 70% da acque.















