Basic HTML Version


3
I primi modelli atomici
UNITÀ
C1
1. I fenomeni elettrici: attrazione e repulsione
Durante quasi tutto il XIX secolo, gli atomi vennero considerati, secondo il
modello atomico di Dalton, come parti indivisibili della materia.
Lo studio dei fenomeni elettrici costrinse tuttavia a riconsiderare la loro struttura.
Era già noto ai Greci, infatti, che strofinando dell’ambra con un panno di lana,
quest’ultima era in grado di attrarre peli e fili di paglia. Anche altre sostanze,
come il vetro, la bakelite e alcuni tipi di plastica (
Figura 1
), presentavano un
comportameno simile all’ambra, il cui nome in greco è
électron
. Per questo
motivo tali manifestazioni vennero chiamate
fenomeni
elettrici
.
Questi comportamenti vennero considerati una semplice curiosità per millen-
ni. Solo a partire dal XVII secolo vennero studiati e si spiegarono ammettendo
che, durante lo strofinio, si producessero
cariche elettriche
. Poiché ambra e
vetro ‘elettrizzati’ attraevano sostanze diverse, si attribuì carica elettrica
posi-
tiva
(
+
) all’ambra e
negativa
(
-
) al vetro.
Gli studi condotti da
Charles-Augustin de Coulomb
(1736-1806) sull’interazio-
ne tra corpi dotati di carica elettrica (
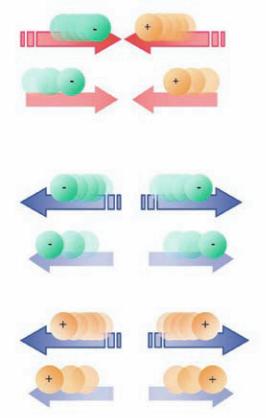
Figura 2
) consentirono di concludere che:
corpi aventi carica elettrica di segno opposto si attraggono;
corpi aventi carica elettrica dello stesso segno si respingono;
le cariche elettriche possono migrare tra corpi diversi;
un corpo che possiede un ugual numero di cariche di segno opposto è neutro;
la forza che agisce tra due cariche elettriche
q
1
e
q
2
è direttamente proporzionale
al loro prodotto e inversamente proporzionale al quadrato della loro distanza (
d
2
)
(
legge di Coulomb
).
F k q q
d
= ⋅
0
1
2
2
La natura del mezzo in cui avvengono le interazioni (aria, vuoto ecc.) modifica il
valore della costante elettrostatica e di conseguenza l’entità della forza tra le cariche.
Nel 1799,
Alessandro Volta
ideò un sistema che chiamò “pila”, perché costi-
tuito da una pila di dischi di rame, zinco e feltro imbevuto di acqua salata,
sovrapposti (
Figura 3
). Con tale apparecchio, il fisico italiano riuscì a generare
flussi intensi e continui di energia: ossia a trasformare in elettricità l’energia
sviluppata nel corso di reazioni chimiche. Successivamente, si riuscì a otte-
nere anche il contrario: far avvenire reazioni chimiche, attraverso l’impiego di
elettricità; ne è un esempio l’elettrolisi dell’acqua, mediante la quale quest’ul-
tima viene decomposta in idrogeno e ossigeno.
L’elettrizzazione per strofinìo, la pila e l’elettrolisi dimostravano che l’elettri-
cità, nei suoi diversi aspetti, è un fenomeno così diffuso da far pensare che la
sua origine vada ricercata nella struttura intima della materia. In altre parole,
si poteva ritenere che gli atomi stessi possedessero una natura elettrica. Questa
nuova considerazione, però, contrastava con il modello di atomo ipotizzato da
Dalton, che era invece privo di cariche.
Per comprendere la natura dell’elettricità, si studiò il suo passaggio nei solidi,
nei liquidi e nei gas.
Figura 1
Un oggetto di plastica, dopo essere
stato strofinato con un panno di lana,
attrae pezzetti di carta.
Figura 2
Le cariche elettriche si attraggono o si
respingono a seconda del loro segno
e con una forza che dipende dalla loro
distanza.
cariche elettriche
forza elettrica
costante elettrostatica
distanza tra le cariche
Figura 3
Ricostruzione della pila
realizzata da Volta.
XII1-029_U07_C1_Chimica_Tottola_CS4-sec imp.indd 3
12/12/11 1

