
La fisica dell'acqua
di Pierdomenico Memeo
- Materie coinvolte: Fisica
La carne di un uomo appartiene a se stesso;
ma la sua acqua appartiene alla tribù.
Frank Herbert, Dune
Il 22 marzo, esattamente un mese prima della più celebre Giornata Mondiale della Terra che cade il 22 aprile, viene celebrata la Giornata Mondiale dell'Acqua. Proposta alla Conferenza delle Nazioni Unite sull'Ambiente e lo Sviluppo di Rio de Janeiro, è stata istituita nel 1993 e da allora viene ricordata per promuovere e coordinare le iniziative per la protezione e la conservazione delle acque del nostro pianeta: quest'anno il tema della giornata è “Accelerare il cambiamento”.
Ma siamo così abituati a sapere che l'acqua è un elemento così prezioso e importante per la vita sulla Terra, che a volte dimentichiamo la fisica molecolare alla base delle caratteristiche che la rendono così speciale.
Una molecola molto speciale
Che la molecola dell'acqua sia formata da un atomo di ossigeno e due idrogeno lo sappiamo fin dalle scuole primarie: anche a causa della sua semplicità, H2O è certamente la prima formula chimica che impariamo, e sicuramente la più conosciuta.
Ognuno degli atomi di idrogeno è unito all'atomo di ossigeno centrale grazie a quello che viene chiamato legame covalente: un legame chimico che comporta la condivisione di elettroni tra gli atomi coinvolti. Ciascuno degli atomi di idrogeno “mette in comune” nella molecola il suo unico elettrone, mentre l'atomo di ossigeno ne mette in comune due, uno per ogni atomo di idrogeno. Grazie a questa “condivisione” ogni atomo di idrogeno si ritrova quindi circondato da due elettroni esterni (uno proprio e uno “in prestito condiviso” dall'atomo di ossigeno), mentre l'atomo di ossigeno si ritrova circondato da 8 elettroni esterni (6 propri e 2 “in prestito” dagli atomi di idrogeno). Questo permette a tutti gli atomi di raggiungere un struttura elettronica equivalente a un guscio elettronico completo, corrispondente alla configurazione più stabile possibile.
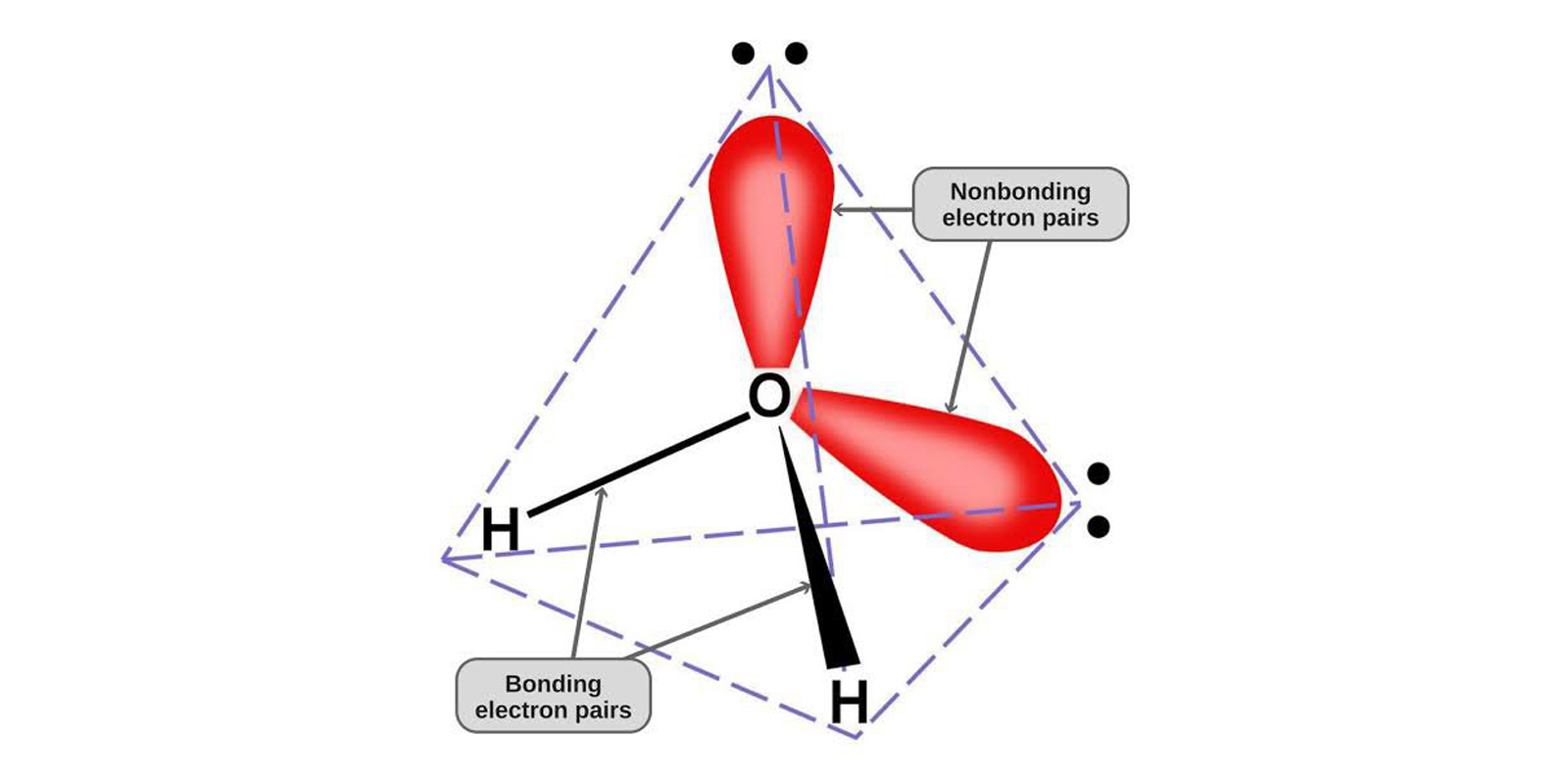
Figura 1. Modello della struttura a tetraedro della molecola d'acqua
Questione di angoli
La ragione è geometrica: l'atomo di ossigeno infatti, oltre ai due legami con gli atomi di idrogeno, possiede nel suo guscio esterno due doppietti di elettroni non condivisi (coppie solitarie), che da qualche parte parte devono essere messi! Di conseguenza, i due atomi di idrogeno e le due coppie solitarie si posizionano in modo da occupare tutto lo spazio a disposizione, rimanendo il più lontano possibile uno dall'altro: si dispongono cioè intorno all'atomo di ossigeno in corrispondenza dei vertici di un tetraetro, un solido regolare con quattro vertici equidistanti dal centro.
Questa struttura geometrica fa sì che la carica elettrica della molecola, globalmente neutra, si distribuisca in maniera asimmetrica, con i due atomi di idrogeno a fare da poli positivi, e le due coppie solitarie da poli negativi: la configurazione è quindi quella di un quadrupolo elettrico (anche se spesso per semplicità viene approssimata a un dipolo).
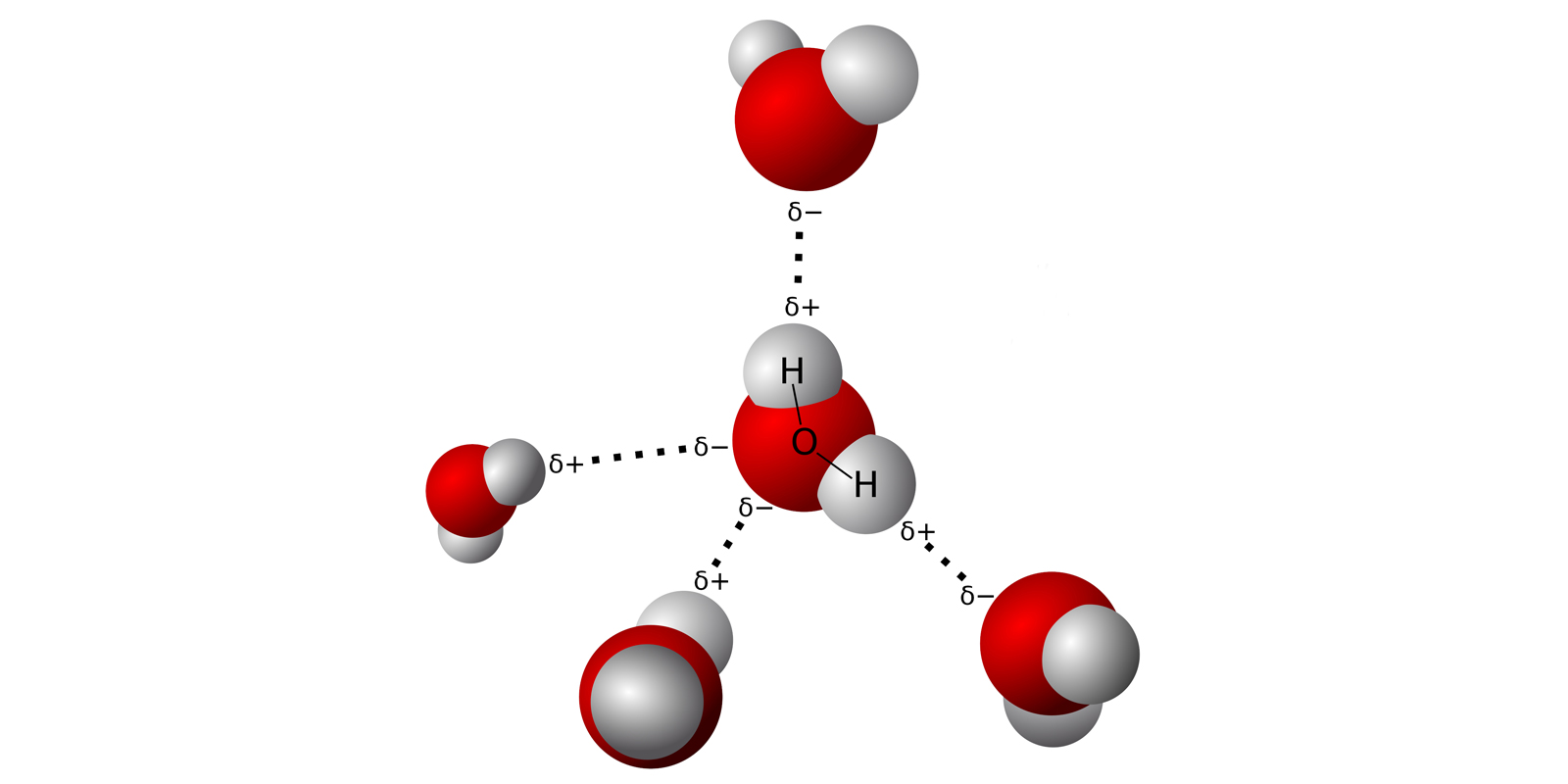
Figura 2. Modello della struttura dei legami a idrogeno per una molecola d'acqua
Legami particolari
Tutto questo discorso può sembrare estremamente astratto, ma le sue conseguenze pratiche sono enormi.
Ogni polo positivo della molecola (rappresentato da uno degli atomi di idrogeno) viene attirato da un polo negativo di un'altra molecola d'acqua (ossia una delle coppie solitarie), e viceversa. Ogni molecola d'acqua può quindi interagire con altre quattro: un’interazione che non è proprio un legame molecolare, ma è più di una semplice forza intermolecolare, che prende il nome di legame a idrogeno.
Quando si trovano vicine, le molecole d'acqua formano quindi un “reticolo”, flessibile ma significativa, tra di loro. Questo fenomeno spiega le caratteristiche così particolari che contraddistinguono l'acqua come sostanza: il suo elevato punto di fusione ed ebollizione, molto più alto di sostanze chimicamente simili, perché è necessario rompere i legami a idrogeno per separare e allontanare le sue molecole; la sua elevata capacità termica, ossia il fatto che è necessario fornire una grande quantità di calore per far innalzare la sua temperatura; il fatto che la sua densità di abbassi durante il processo di congelamento, formando strutture con simmetria esagonale, con la conseguenza che il ghiaccio galleggi sull'acqua liquida, con tutte le sue implicazioni sulla biosfera; la tensione superficiale, che permette all'acqua di creare una forza di superficie che intrappola le sue stesse molecole formando gocce e bolle, ; la formazione di clatrati idrati, “gabbie” formate da molecole d'acqua che circondano ioni o macromolecole, un fenomeno fondamentale per i processi biologici; e infine, la sua elevata attitudine come solvente, capace di complessare sia sostanze organiche che inorganiche.
È quindi estremamente affascinante pensare come qualcosa di così semplice come la forma di una molecola relativamente piccola possa avere conseguenze così importanti su tutto il nostro mondo e sulla preziosa e delicata catena della vita sul nostro pianeta.

Proposta di attività per la classe: L'acqua la insegna la sete
Grazie alle sue caratteristiche uniche, l'acqua ha acquisito un significato culturale importantissimo praticamente in ogni contesto umano: dalla sacralità dei fiumi lungo i quali sono sorte molte civiltà antiche (Nilo, Tigri e Eufrate, Gange e Indo, Huang He, e altri), alle divinità acquatiche primigenie comuni a molte religioni politeiste, dai sistemi di filosofia naturale che la consideravano un elemento fondamentale della realtà (ad esempio il sistema dei quattro elementi aristotelici o dei cinque elementi taoisti), alle pratiche di purificazione rituale ancora diffusa in molte culture. Anche la poesia ha dedicato ampio spazio all'acqua, sia come simbolo che come ispirazione; e ancora oggi l'acqua è al centro di discussioni riguardo supposte (e mai provate scientificamente) proprietà mnemoniche e curative, come per esempio nelle preparazioni omeopatiche.
Per svolgere l'attività, studenti e studentesse dovranno scegliere un brano culturalmente significativo (poesia, testo sacro, filastrocca, preghiera, canzone, o altro) che abbia un riferimento esplicito all'acqua, ne analizzeranno la simbologia e le ispirazioni, trovando collegamenti con le caratteristiche chimico-fisiche dell'acqua.
Per esempio:
- Riferimenti a riti di purificazione: capacità dell'acqua di sciogliere diverse sostanze grazie alla polarità della sua molecola;
- Riferimenti alla presenza di ghiaccio sulla superficie dell'acqua: diminuzione della densità dell'acqua durante il processo di congelamento;
- Riferimenti all'acqua come fonte di vita: importanza dell'acqua nei processi biologici;
- eccetera..
Per sua natura, si tratta di una attività a svolgimento aperto, e dovranno essere considerate sia l'originalità della scelta del brano, sia la capacità di cogliere i collegamenti scientifici nei testi letterari e culturali.
Sitografia
Giornata mondiale dell'acqua
Why water is really, really weird (in inglese)
BBC Ideas
Esistono due tipi di acqua allo stato liquido
Articolo giornalistico divulgativo
Il killer invisibile
La beffa del monossido di diidrogeno
Hai paura della chimica? - saperi forti
Bibliografia
Una biografia
Giulio Boccaletti
Mondadori (2022)
ISBN: 9788804749202
Acqua
Edizione illustrata
Curatore Gruppo Lions Foto Italia
Edizioni Artestampa (2021)
ISBN: 9788864628141
Il libro dell'acqua
La storia straordinaria della più ordinaria delle sostanze
Alok Jha
Bollati Boringhieri (2019)
ISBN: 9788833931838















